はじめに
医療機器の品質管理において、品質マニュアル(品質管理監督システム基準書)は非常に重要な文書です。これは、企業の品質管理システム全体を概説し、品質に関する方針や手順の指標となるものです。本記事では、大阪府健康医療部生活衛生室薬務課が作成した「品質管理監督システム基準書モデル」を基に、初心者の方でも理解しやすいよう、自社向けの品質マニュアル作成方法を詳細に解説します。
医療機器の品質マニュアルが特に重要である理由は、以下のとおりです:
- 法的要求事項の遵守:医療機器は人の生命や健康に直接関わるため、厳格な品質管理が求められます。品質マニュアルは、当該医療機器に関する全ての要求事項を満たすための基本的な文書となります。従いまして、(企業の事業内容および方針によるが)QMS省令だけでなく、医機法、GMP省令、消防法、ISO規格、海外規制、企業方針などの要求事項も品質マニュアルに盛り込むことが必要となります。
- 品質管理システムの標準化:品質マニュアルにより、組織全体で一貫した品質管理の方法を共有し、実践することができます。
- 継続的改善の基盤:品質マニュアルは、品質管理システムの現状を把握し、改善点を特定するための基準となります。
- 外部監査への対応:規制当局による査察や認証機関による審査の際に、品質マニュアルは重要な評価対象となります。
- 従業員の教育ツール:品質マニュアルは、新入社員を含む全従業員に対して、会社の品質方針や品質管理システムを理解させるための効果的な教育ツールとなります。
- リスク管理の基盤:品質マニュアルには、リスクマネジメントの方針や手順が含まれており、製品のライフサイクル全体を通じたリスク管理の基盤となります。
- トレーサビリティの確保:品質マニュアルに基づいて作成される記録により、製品の設計から製造、出荷後の追跡まで、一貫したトレーサビリティを確保することができます。
品質マニュアルの基本構造
品質マニュアルの基本構造を理解することが、カスタマイズの第一歩となります。一般体には、以下のような構成になっています:
- 目的
- 適用範囲
- 引用規格
- 用語の定義
- 品質管理監督システム
- 経営者の責任
- 資源の運用管理
- 製品実現
- 測定、分析及び改善
- その他の要求事項
- 電磁的記録等について
この構成は、ISO 13485:2016(医療機器における品質マネジメントシステムの国際規格)とも整合性がとれています。各章では、QMS省令の要求事項に対応する形で、企業の品質管理システムの各要素が説明されています。
各章の概要は以下の通りです:
- 目的:品質マニュアルの目的を明確に述べます。この章では、品質マニュアルが会社の品質管理システムの基本文書であることを明確にし、関連法令遵守(と顧客満足の両立)を目指すことを宣言します。
- 適用範囲:品質マニュアルが適用される組織、製品、プロセスを定義します。ここでは、会社の製造販売業許可や製造業登録の情報、対象となる製品カテゴリー、適用事業所、組織、適用除外項目(該当する場合)、外部委託範囲を明記します。
- 引用規格:品質マニュアルの作成に使用された規格や法令を列挙します。QMS省令、ISO 13485、ISO 14971(リスクマネジメント)などの関連規格を記載します。
- 用語の定義 適用が必要な関連規格間で用語の定義が違っている場合、企業独自の定義がある場合などに具体的な定義を明確にします。法令、規格書等の定義そのものである場合は、省略するか、「xx規格の用語の定義に従う」旨の記載をしておくことで構いません。
- 品質管理監督システム:品質管理システムの全体的な要求事項を説明します。この章では、品質管理システム全般の構造、文書体系、プロセスアプローチ、リスクアプローチ、医療機器販売業など他業態との関連、品質管理システムのバリデーション(CSV)などについて記述します。
- 経営者の責任:トップマネジメントの責任と関与について詳述します。品質方針の策定、品質目標の設定、マネジメントレビューの実施など、QMS関連の各責任者の具体的な責任と役割を明確にします。
- 資源の運用管理:人材、インフラ、作業環境の管理について説明します。従業員の教育訓練、設備の保守管理、作業環境の整備など、品質管理に必要な資源の確保と管理方法を記述します。
- 製品実現:製品の設計から製造、出荷までのプロセスを詳細に記述します。リスクマネジメント計画、設計開発、購買管理、製造管理、設置、滅菌や包装などの特殊工程、製造プロセス等のバリデーション、トレーサビリティの確保、製品の保管管理、設備・機器の管理などについて具体的に説明します。
- 測定、分析及び改善:品質管理システムの有効性を評価し、改善するための方法を説明します。製品受領者からの意見収集、苦情処理、内部監査、不適合管理、是正措置・予防措置(CAPA)などの手順を記述します。
- その他の要求事項:QMS省令以外の法令等で求められる追加的な要求事項について記述します。不具合報告や回収報告の手順、製造販売後安全管理(GVP)などを明確にします。
- 電磁的記録等について:電子記録の取り扱いに関する規定を記述します。電子署名の運用、データのバックアップ、セキュリティ管理などについて説明します。
品質マニュアルのカスタマイズ方法
会社情報の記載
品質マニュアルの冒頭部分には、文書の基本情報を記載します。具体的には以下の項目を含めます:
これらの情報は、品質マニュアルが自社のものであることを明確にし、また規制当局への提出時にも必要となります。
例えば、以下のような形式で記載します:
- 会社名:株式会社医療機器プロ
- 版数:第1.0版
- 制定日:2023年4月1日
- 改定日:-
この情報は、品質マニュアルの表紙や冒頭ページに記載します。また、改定履歴を記録するページを設け、品質マニュアルの更新履歴を管理することも重要です。
改定履歴には、以下の情報を含めるとよいでしょう:
- 版数
- 改定日
- 改定内容の概要
- 改定理由(法改正対応、組織変更、プロセス改善など)
- 作成者
- 審査者
- 承認者
これにより、品質マニュアルの変更の経緯が明確になり、必要に応じて過去の版を参照することができます。
適用範囲の設定
「2. 適用範囲」の章では、品質マニュアルが適用される組織や業務を明確にします。サンプルでは以下のように記載されています:
- 2.1 適用する組織
- <第●種医療機器製造販売業>
- 許可番号:27B●X●●●●●
- 名称:株式会社○○○○
- 所在地:大阪府XX市XX区XX
自社の情報に合わせて、製造販売業の種別、許可番号、名称、所在地を記入します。また、製造所や営業所など、品質管理システムが適用される全ての組織を記載します。
さらに、適用範囲には以下の情報も含めるとよいでしょう:
- 対象となる製品カテゴリー(例:非能動植込み型医療機器、画像診断装置など)
- 適用除外項目(該当する場合)とその理由
- 外部委託している重要なプロセス(ある場合)
例えば:
- 2.2 適用する業務
- 本品質マニュアルは、当社が製造販売する非能動植込み型医療機器の設計開発、製造、販売及びアフターサービスに関する全ての業務に適用する。
- 2.3 適用除外条項
- 滅菌医療機器を製造販売しないため、QMS省令第44条及び第46条(滅菌医療機器関係)は適用除外とする。
- 2.4 外部委託プロセス
- 以下のプロセスを外部委託する:
- 製品の最終組立て:○○製作所
- 滅菌処理:△△滅菌サービス株式会社
- これらの外部委託プロセスについても、本品質マニュアルに基づく管理を行う。
QMS省令では、QMSサブプロセスの適用除外、非適用を認めていますが、第七条第一項では、「適用を除外する事項」と「非適用とする事項」を別のものとして扱っています。「適用除外」とはQMS省令により、その適用を除外することが許容されている要求事項で、企業の取扱い製品の都合で適用する必要がない項目(滅菌工程など)は「非適用」となりますため、別々に記載しておくことを推奨します。
適用除外項目がある場合は、その理由を明確に説明することが重要です。これにより、規制当局や認証機関による審査の際に、適用除外の妥当性を示すことができます。
また、外部委託プロセスはQMSの工程を委託しているだけであり、「非適用」でないことに注意しましょう。
品質管理監督システム
この章には、品質マニュアルに規定するサブプロセスの概要とその取扱いに関することを記載します。
プロセスアプローチ
QMS省令の各サブプロセスは独立しているのでなく、相互に関連しています。これらのサブプロセスがどのように関連しているのかを示す必要があります。また、委託した工程に関しても、その説明責任は委託元となる企業に残りますので、どの工程を外部委託しているのかを明確に示す必要があります。QMSの体系図(例:大阪府健康医療部生活衛生室薬務課作成の「品質管理監督システム基準書モデル別紙様式集」の「附図3 品質マネジメントシステム体系図」)を別添として示す必要があります。また、取決め書を締結していることなどがわかる外部委託先とのQMSの相互関係図(「QMS適合性調査の申請に当たって提出すべき資料」の「記載例2」にある図)も別添として品質マニュアルに含めることを推奨します。
リスクアプローチ
QMS省令ではリスクアプローチを採用することを規定しています。
全ての活動、製品を画一的な運用するのでなく、製品の有効性、安全性、品質に影響を与える度合いで対応内容を変えるアプローチとなります。例えば、以下のアプローチが考えられます。
- 教育訓練:
- リスクマネジメント責任者、内部監査員、および製品を取り扱う組織、従業員には作業の認定及び更新審査を適用する
- その他の従業員は自己申請による教育訓練の理解度確認とする
- 購買管理:
- 製品の構成品、品質確認、製造サービス委託に関する供給業者には取決め書ならびに定期的な実地監査を行う
- その他の供給業者は取決め書は不要とし、定期監査はアンケートもしくは書面調査とする
- 是正措置:
- 製品の安全性リスクが中程度以上の場合は統計的手法を用いた原因分析を実施する
- 製品の安全性リスクが低の場合は、統計的手法を用いた原因分析を推奨する
これらのリスクアプローチを適用するプロセスとその考え方も企業の要求事項として記載しておくことが望まれます。
プロセスの特定と文書化
- 企業が適用するQMSサブプロセスに係る要求事項は何かを規定します。
最低限の内容としては。「何を」しなくてはいけないかを記述することです。 - 「だれが」、「いつ」、「どのように」行うかの具体的な内容は下位文書となる手順書に記載しましょう。
QMSを適用する事業所が複数あり、事業所単位で適用範囲、要求事項が変わる場合は、どの事業所にどこまでの要求がかかるかを明確にします。別紙として、各QMSサブプロセスと事業所ごとの適非を表にまとめておくとわかりやすくなります。(「品質管理監督システム基準書モデル別紙様式集」の「附図2 各部門と工程の関連表」参照) - また、適用除外、非適用のサブプロセスも項は削除せずに残しておくことを推奨します。
事業内容、製造販売する製品の種類が変わり、これまで適用除外もしくは非適用していたサブプロセスが必要となるかもしれません。後で追加すると各サブプロセスの項番号の変更が必要となり、品質マニュアル内の参照番号および関連手順書への影響も発生する可能性があります。このような単なる事務作業の文書改訂を防ぐためにもQMS省令にある全てのサブプロセスは品質マニュアルに残しましょう。
このように具体的な記載が不要な場合は、以下のように記載しておくのが良いでしょう。
- 適用除外の場合: 当社における本プロセスは適用除外とする。適用除外の根拠は本品質マニュアルの「適用」を参照すること。
- 非適用の場合: 当社における本プロセスは非適用とする。非適用の根拠は本品質マニュアルの「適用」を参照すること。
- 外部委託の場合: 当社における本プロセスはxx製造所に委託することとする。委託先の本プロセスの運用状況に関しては、購買管理手順に従ったxx製造所との取決め書にて明確にする。
法令遵守の確認
品質マニュアルの内容が、最新のQMS省令や関連法規に準拠していることを確認することが重要です。法改正があった場合は、速やかに品質マニュアルを更新する必要があります。
例えば、QMS省令の改正情報は厚生労働省のウェブサイトで確認できます。また、業界団体や専門誌などからも最新の法規制情報を入手し、常に最新の要求事項に対応できるようにしましょう。
法令遵守を確実にするため、以下のような取り組みも有効です:
- 法規制情報の定期的なレビュー:四半期ごとなど、定期的に法規制の変更をチェックする仕組みを作る。
- 外部専門家の活用:必要に応じて、薬事コンサルタントや弁護士などの専門家にレビューを依頼する。
- 教育訓練の実施:関連部門の担当者に対し、定期的に法規制に関する教育を行う。
- 法規制要求事項と品質マニュアルの対応表の作成:QMS省令の各条項と品質マニュアルの該当箇所を対応させた表を作成し、漏れがないことを確認する。
- 法改正情報のアラートシステムの導入:PMDAや厚生労働省のメールマガジンなどを活用し、法改正情報をタイムリーに入手する。
手順書一覧
各品質マニュアルの要求事項を遵守するため、具体的にどのような運用を行うかは下位文書となる手順書に記載します。品質マニュアルでは、どの手順書にその運用方法を記載しているかの手順書タイトルと文書管理番号を紐付けしておくことが必要です。各項の文中に手順書の情報を記載するか、別紙として各QMSサブプロセスに関する手順書一覧表を作成しましょう。
QMS省令が要求する文書と記録がどの社内手順書に該当するかがわかるように手順書一覧表を作成しておくと行政調査の際に役立ちます。
医療機器販売業など他業態との関連
医療機器製造販売業および製造業以外の業態(販売業、修理業など)許可を取得している場合、それらの業態に関するQMSをどのように取り扱うかを明確にする必要があります。例えば、医療機器販売業で要求されている教育訓練、倉庫管理などがQMSの教育訓練手順書、環境管理手順書、製品保管手順書などに従って運用している場合は、そのことがわかる記述が必要となります。
QMS手順一覧に他業態が採用している文書を示すか、各手順書の適用範囲に関連業態を記載するようにしましょう。他業態に適用しない場合は、別文書で管理することを記載しておけば構いません。
品質管理システムのバリデーション(CSV)
QMSで文書管理システム、記録管理システム、製品在庫管理システム、CAPA管理システムなどのコンピュータシステムを利用している場合、コンピュータシステムバリデーションが必要と規定されています。リスクアプローチを踏まえ、どのシステムをどのように管理するかの方針を定め、品質マニュアルに規定しておくことが必要です。
その他のサブプロセス
品質マニュアル、製品標準書、文書管理、記録管理に関しても、どのように管理するかを規定します。
経営者の責任
品質方針と品質目標の策定
「品質方針」と「計画」の章では、会社の品質方針と品質目標を定義します。品質方針は会社の品質に対する基本的な考え方を表すもので、管理監督者である経営者が策定します。一般的に品質方針は、大きな事業内容の変更、事業方針の変更、経営者の変更などがない限り継続されることが多いです。品質方針の内容変更が必要な場合は、マネジメントレビュー等で経営者が指示を出します。品質目標はこの方針に基づいて、短中期的で具体的かつ測定可能な目標を設定します。
品質方針の例:
- 当社は、患者様の安全と健康を最優先に考え、以下の品質方針を定める:
- 法令及び規制要求事項を遵守し、安全で有効な医療機器を提供する。
- 顧客要求事項を的確に把握し、顧客満足度の向上に努める。
- 品質マネジメントシステムの有効性を継続的に改善する。
- 全従業員の品質意識向上を図り、品質第一の企業文化を醸成する。
- リスクマネジメントを徹底し、製品のライフサイクル全体を通じて安全性を確保する。
この品質方針に基づく品質目標の例:
- 製品不具合発生率を年間0.1%以下に抑える。
- 顧客満足度調査で90%以上の満足度を達成する。
- 内部監査で指摘された不適合事項の90%以上を3ヶ月以内に是正する。
- 全従業員に年間10時間以上の品質関連教育を実施する。
- 新製品開発時のリスクアセスメントを100%実施し、特定されたリスクに対する低減措置を講じる。
- 市販後安全管理情報を毎月分析し、必要に応じて30日以内に是正措置を講じる。
品質目標は、SMART(Specific:具体的、Measurable:測定可能、Achievable:達成可能、Relevant:関連性がある、Time-bound:期限がある)の原則に従って設定することが重要です。
また、品質目標は組織の各レベル(会社全体、部門、個人)で設定し、それぞれの責任と権限を明確にすることが望ましいです。例えば:
会社全体の目標:
製造部門の目標:
- 製造工程での不良率を0.5%以下に抑える。
- 製造設備の計画外停止時間を月間2時間以内に抑える。
品質保証部門の目標:
- 出荷前の品質検査合格率を99.9%以上にする。
- 顧客クレームの平均処理時間を5営業日以内にする。
個人レベルの目標:
- 担当する工程での作業ミスをゼロにする。
- 品質関連の社内研修を年間15時間以上受講する。
これらの目標は、定期的(通常は年1回)に見直し、必要に応じて更新します。また、目標の達成状況を定期的にモニタリングし、未達成の場合は原因分析と対策立案を行うことが重要です。
組織体制の明確化
「責任、権限及びコミュニケーション」の章では、品質管理に関わる各役職の責任と権限を明確にします。特に重要なのは以下の役職です:
- 管理監督者(通常は社長、もしくは医療機器事業部の責任者)
- 管理責任者
- 医療機器等総括製造販売責任者
- 国内品質業務運営責任者
- 製造管理者(責任技術者)
これらの役職の任命方法、責任範囲、権限を明確に記載します。
市販後完全管理業務をQMSの適用範囲に入れる場合は、安全管理責任者の責任と権限も明確にします。この時、総括製造販売責任者は安全管理業務に関しても責務を持つことから、総括製造販売責任者の責任に安全管理業務に関する責任も追加する必要があります。
例えば、管理責任者の責任と権限は以下のように記載できます:
管理責任者
管理監督者は、当社の役員、管理職の地位にある者その他これに相当する者のうちから管理責任者を任命する。管理責任者は、以下の責任と権限を有する:
- 品質管理監督システムに必要なプロセスの確立、実施、維持を確実にする。
- 品質管理監督システムの実効性及びその改善の必要性について管理監督者に報告する。
- 組織全体にわたって、法令の規定等及び品質管理監督システムの要求事項についての認識を高める。
- 外部の利害関係者との品質管理監督システムに関する事項の連絡窓口となる。
- 品質目標の設定と達成状況のモニタリングを行う。
- 内部監査の計画立案と結果の評価を行う。
- 是正措置及び予防措置の有効性を評価する。
- 品質管理監督システムのパフォーマンスデータを分析し、改善の機会を特定する。
また、組織図を用いて各役職の関係性を視覚的に示すことも効果的です。組織図には、以下の情報を含めるとよいでしょう:
- 各部門の名称と責任者
- 品質管理に関する主要な役職(管理責任者、医療機器等総括製造販売責任者など)
- 各役職間の報告ライン
- 品質管理に関する委員会(例:品質管理委員会、安全管理委員会)
組織図の例:
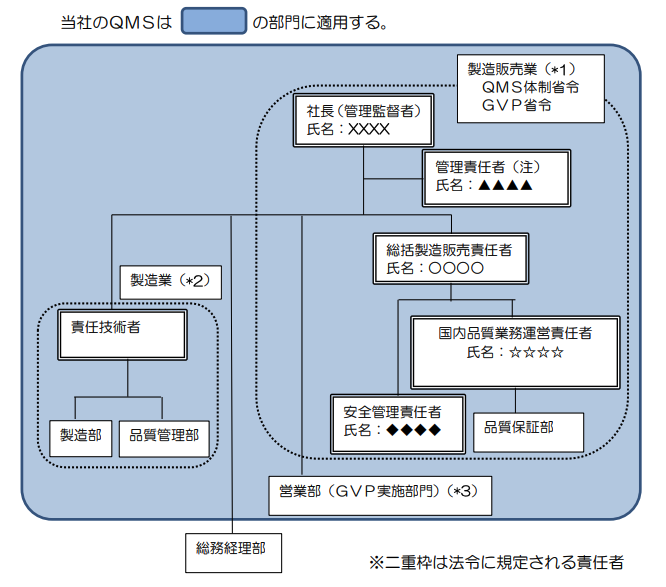
引用:大阪府 品質管理監督システム基準書モデル(第3版)別冊様式集
このような組織図を作成することで、品質管理に関する責任と権限の所在が明確になります。また、組織変更があった場合は、速やかに組織図を更新し、品質マニュアルに反映させることが重要です。
ただし、品質マニュアルの改訂を必要以上増やさないために、組織図を別文書として管理する、組織図に含める個人名は「責任、権限及びコミュニケーション」に記述した責任者までとするなどを推奨します。
その他の品質マニュアル作成時の注意点
要求事項を網羅する
サンプルにある各サブプロセスの内容はQMS省令のみ考慮したものです。企業によって遵守すべき法令、規格、規定等が違いますので、必ず企業の実態に合った要求事項を網羅するようにしましょう。
事業所によって適用する要求事項が変わる場合は、書き分けるか、下位文書として事業所ごとのサブ品質マニュアル(規定書)を設けることを推奨します。
わかりやすい文章表現
品質マニュアルは社内の全ての従業員が理解し、遵守すべき文書です。QMS省令をはじめとする法令の文章がわかりにくい場合は、専門用語の使用は必要最小限に抑え、わかりやすい文章で記述することが大切です。必要に応じて図表や例示を用いて説明を補足するとよいでしょう。
わかりやすい文章を書くためのポイントは以下の通りです:
- 簡潔な文章を心がける:一文を短くし、複雑な言い回しを避ける。
- 能動態を使用する:「~される」という受動態よりも「~する」という能動態の方が理解しやすい。
- 図表を活用する:プロセスの流れや組織図などは、図表で表現すると分かりやすい。
- 用語集を作成する:専門用語や略語については、巻末に用語集を設けて説明を加える。
- 箇条書きを活用する:関連する項目をまとめて箇条書きにすることで、情報が整理される。
- 見出しを効果的に使用する:階層化された見出しを使用することで、文書の構造が理解しやすくなる。
- レイアウトを工夫する:適切な余白や行間を設けることで、読みやすさが向上する。
例えば、以下のような文章は:
- 品質方針の周知徹底が従業員に対してなされるべきである。
次のように書き換えるとわかりやすくなります:
- 管理責任者は、全従業員に品質方針を理解させ、日々の業務で実践させる。具体的には、以下の方法で周知徹底する:
- 品質方針をポスターにして各部署に掲示する
- 年2回の全体会議で品質方針について説明する
- 新入社員研修で品質方針の教育を行う
- 品質方針カードを全従業員に配布し、常時携帯させる
- 部門ごとに品質方針に基づく具体的な行動目標を設定し、定期的にレビューする
定期的な見直しと更新
品質マニュアルは「生きた文書」であり、定期的に見直しと更新を行う必要があります。サンプルの冒頭にある改訂履歴のような形で、更新の記録を残すことも重要です。
品質マニュアルの見直しと更新のプロセスは以下のように行うことができます:
- 定期的なレビュー:少なくとも年1回は品質マニュアル全体を見直す。
- 変更の必要性の評価:法規制の変更、組織変更、プロセスの変更などがあった場合、品質マニュアルへの影響を評価する。
- 変更案の作成:必要な変更を特定し、品質マニュアルの改訂案を作成する。
- レビューと承認:変更案を関係部門でレビューし、最終的に管理監督者(通常は社長)が承認する。
- 変更の周知:承認された変更内容を全従業員に周知する。
- 教育訓練:必要に応じて、変更された内容に関する教育訓練を実施する。
- 有効性の確認:変更後の品質マニュアルの有効性を、内部監査や日常業務を通じて確認する。
品質マニュアルの更新履歴は、以下のような形式で記録します:
- 改訂履歴
- 版数 改訂日 改訂内容 承認者
- 1.0 2023/4/1 初版作成 社長 山田太郎
- 1.1 2023/7/1 組織図の更新 社長 山田太郎
- 1.2 2023/10/1 QMS省令改正に伴う修正 社長 山田太郎
- 1.3 2024/1/15 リスクマネジメントプロセスの強化 社長 山田太郎
このような記録を残すことで、品質マニュアルの変更履歴を追跡し、必要に応じて過去の版を参照することができます。また、規制当局の査察や認証機関の審査の際に、品質マニュアルの継続的な改善の証拠として提示することができます。
品質マニュアルは各QMSサブプロセスの最上位文書となりますので、品質マニュアルを改訂すると、関連するQMS手順書の改訂が必要になることが多いです。そのため、品質マニュアルを改正する際に、関連手順書への影響も評価することが大事となります。複数の文書に重複した内容を記載すると改訂忘れのリスクが増えます。できるだけ、該当文書へのリンクにとどめましょう。
まとめ
品質マニュアルの作成は、一朝一夕にできるものではありません。会社の品質管理システム全体を見直し、文書化する作業には時間と労力がかかります。しかし、適切に作成された品質マニュアルは、以下のような大きなメリットをもたらします:
- 品質管理システムの全体像の明確化:品質マニュアルにより、会社の品質管理システムの全体像が明確になり、各プロセスの相互関係が理解しやすくなります。
- 従業員の品質意識向上:品質マニュアルを通じて、全従業員が会社の品質方針や目標を理解し、日々の業務で実践することができます。
- 規制当局の査察への対応:品質マニュアルは、規制当局による査察の際に重要な評価対象となります。適切に作成された品質マニュアルは、査察への円滑な対応を可能にします。
- 継続的な品質改善の基盤:品質マニュアルに基づいて実施される内部監査や管理評価により、品質管理システムの弱点を特定し、継続的に改善することができます。
- 新入社員の教育ツール:品質マニュアルは、新入社員に会社の品質管理システム全般を理解させるための優れた教育ツールとなります。
- 取引先との信頼関係構築:取引先に品質マニュアルの概要を示すことで、自社の品質管理に対する真剣な姿勢をアピールし、信頼関係を構築することができます。
- リスク管理の強化:品質マニュアルにリスクアプローチを組み込むことで、企業におけるリスク管理の程度が明確になります。
- 業務の標準化:品質マニュアルでどのプロセスに手順書の作成が必要かを明確にすることで、業務の標準化が進み、品質のばらつきを減らすことができます。
- コンプライアンスの確保:企業が遵守しなければいけない法令要求事項を品質マニュアルに反映させることで、コンプライアンス違反のリスクを低減できます。
- 経営判断の支援:品質マニュアルに基づいて収集されたデータや分析結果は、経営判断の重要な情報源となります。
品質マニュアルサンプルを参考にしながら、自社の特性に合わせてカスタマイズを行い、実効性のある品質マニュアルを作成してください。また、作成後も定期的な見直しと更新を行い、常に最新の状態を保つことが重要です。
品質マニュアルの作成は、医療機器の品質と安全性を確保するための重要なステップです。患者様の安全と健康に直結する医療機器の品質管理に、この品質マニュアルが貢献することを願っています。適切な品質管理システムの構築と運用により、高品質な医療機器を提供し、医療の質の向上に寄与することができるでしょう。
最後に、品質マニュアルの作成はゴールではなく、継続的な品質改善活動のスタートポイントであることを強調しておきます。














